از اهداف مواد ضدمیکروب، غیرفعال سازی میکروارگانیسم هایی می باشد که منجر به ایجاد بو و بیماریهای واگیردار می شوند. جهت رسیدن به این هدف مواد ضدمیکروب زیادی در طول سالیان سال توسعه پیدا کرده اند. توجهات اخیر در زمینه بیماریهای واگیردار و تروریسم باعث افزایش صعودی در مواد ضد میکروب شده است. بنابراین، شناخت مواد ضد میکروب و مکانیسم غیرفعال سازی آنها بسیار ارزشمند می باشد. مواد ضد میکروب برحسب شدت عملیات به سه دسته تقسیم می شوند:
– پاک سازی : به عملیاتی گفته می شود که در آن میکروارگانیسم ها تا سطح تعیین شده برای بهداشت عمومی کشته یا غیرفعال می شوند. در این حالات تعداد میکروارگانیسم ها در محیط تا حد قابل توجهی کاهش می یابد اما این به معنی از بین رفتن تمام میکروارگانیسم ها نمی باشد. . – ضد عفونی : به فرآیندی گفته می شود که قارچها و باکتری ها البته نه اسپورهای آنها را از بین می برد. سه سطح ضعیف، متوسط و قوی برای ضد عفونی کننده ها با کاربردهای خاص پیشنهاد شده است.
– گندزدایی: حذف، از بین بردن یا کشتن تمام انواع میکروارگانیسم ها به همراه اسپورهای آنها می باشد. اسپورها اغلب به سختی از بین می روند. بنابراین بهترین حالت برای غیرفعال سازی میکروارگانیسم ها می باشد. سیستم های متداول در گندزدایی شامل بخار تحت فشار(اتوکلاوها )، حرارت خشک(آون ها) و استفاده از مواد شیمیایی می باشد. از روش های غیر متداول و جدید می توان به روش پلاسما و تابش گاما اشاره کرد[۲].
مواد ضدمیکروب
به طور کلی ترکیبات ضدمیکروب بسیاری وجود دارد که از آنها در صنایع متفاوت استفاده می گردد که در ذیل به برخی از آنها اشاره خواهد شد:
جنتامیسین، آنتی بیوتیک ها، نمکهای تری آلکیل تین و استرها، الکل ها (اتیل، ایزوپروپیل، تری کلرو بوتانول)، آلدئیدها (فرمالدئید، گلوتارآلدئید)، تیوفنل ها، آلکیل فنل ها، یونهای فلزی، صابون های سنگین، تیوکربامات ها، نمک های معدنی فلزات سنگین، آمین ها، ایمین ها و ایمیدها، سولفونیل آمیدها، مرکاپتوبنزو تری آزول ، فنل های کلرینه، نمکهای آلکیل و آریل جیوه، رنگها، مواد فعال سطحی (ترکیبات آمونیوم نوع چهارم)، کمپلکس های هالوژن، زئولیت ها و گازها (اتیلن اکساید، فرمالدئید، بتاپروپیولاکتون)، مواد کاتیونیک، پراکسیژن ها، بعضی نرم کن های مورد استفاده در نساجی مانند اوره اتیلن اکتا دسیل، آمین کندانسه و بعضی نرم کن های کاتیونی[۱].
آلدئیدها با آلکیلاسیون گروههای آمینو، ایمینو، آمید، کربونیل و تیول از متابولیسم و چرخه تولید مجدد پروتئین ها، RNA و DNA جلوگیری به عمل می آورند. همچنین این مواد می توانند به اجزاء سازنده دیواره سلولی/ اسپور آسیب برسانند. بر قارچ ها و مخمرها نیز موثر می باشند. بخار فرمالدئید به عنوان پاک کننده محل نگهداری طیور و حیوانات اهلی و سطوح غیر خوراکی استفاده می گردد. از فرمالدئید برای نگهداری اجساد نیز استفاده می گردد. این ماده سرطان زا بوده و از پایداری خوبی در محیط برخوردار می باشند. انواع فرمالدئیدهای مقاوم به اشرشیاکلی و Serratia marcescences شناخته شده است. گلوتار آلدئید با گروههای آمینو در پروتئین باکتری پیوند عرضی برقرار می کند. ارتوفتال آلدئید یک دی آلدئید آروماتیک می باشد که بر باکتری گرم مثبت و گرم منفی موثر بوده ولیکن نسبت به گلوتار آلدئید از اثر کراسلینک ضعیف تری برخوردار می باشد[۲].
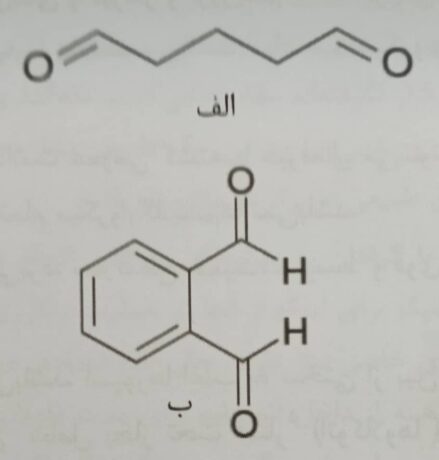
شکل ۱- ساختارهای الف- گلوتار آلدئید، ب- ارتوفتال آلدئید[۲]
مواد کاتیونیک موجب پاره شدن غشاء باکتری شده و به انواع مختلفی از میکروارگانیسم ها شامل باکتری گرم مثبت و گرم منفی آسیب می رسانند. کلروهگزیدین و ترکیبات آمونیوم نوع چهارم مثال خوبی از مواد کاتیونیک می باشند. صابون های ضد میکروب، دهان شویه و ژل های ضد عفونی کننده ی دست کاربردهای معمول از کلروهگزیدین می باشد. اگر میکروب با کلروهگزیدین در تماس مداوم باشد نسبت به آن مقاومت نشان خواهد داد[۲].
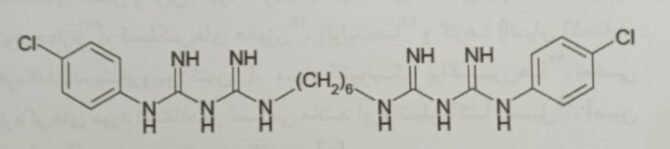
شکل ۲- ساختارهای کلروهگزیدین[۳]
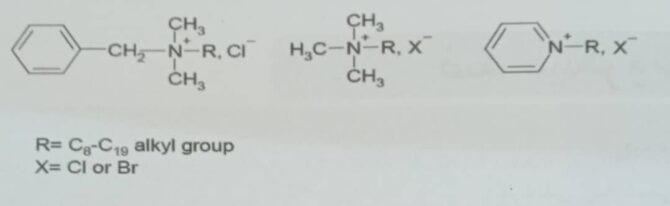
شکل ۳- ساختارهای نمک های آمونیوم نوع چهارم[۲]
بیگونایدها مانند کلروهگزیدین و آلکسیدین به شکل پلیمری استفاده می شوند که این مواد آسیب قابل توجهی به غشاء داخلی اشرشیاکلی می رسانند. ترکیبات آمونیوم نوع چهارم مانند کلرید بنز آلکوئیم، بروماید آمونیوم دو دسیل تری متیل و کلراید ستیل پیریدینیوم، با از بین بردن غشاء خارجی باعث از بین رفتن میکروارگانیسم ها می شوند. ترکیبات آمونیوم نوع چهارم یک زنجیر بلند هیدروکربن می باشند که در آن نیتروژن جایگزین شده است. معمولاً محدوده زنجیرC8H17 تا C19H39 می باشد که بهترین فعالیت در C14H29 می باشد. مکانیسم عمل بر اساس برهم کنش الکترواستاتیک بین +N در ترکیبات آمونیوم نوع چهارم و سطح سلولی میکروارگانیسم که دارای بار منفی می باشد است که باعث ایجاد نقصان در لایه شده و زنجیر آبگریز به دیواره سلولی نفوذ می کند که در نتیجه آن تخریب اتفاق می افتند. ترکیبات آمونیوم نوع چهارم نوعی از سطح فعال های یونی می باشند و به عنوان ماده ضد عفونی کننده و دترجنت عمل می کند. ترکیبات آمونیوم نوع چهارم در مقابل باکتری گرم منفی بسیار ضعیف عمل کرده و بر اسپورها نیز اثری ندارند[۲].
الکل ها (R-OH) نیز فعالیت ضد میکروبی دارند. از خصوصیات این مواد می توان به از بین بردن سریع باکتری ها اشاره کرد الکل ها با ایجاد پیوندهای هیدروژنی با پروتئین ها / آنزیم ها باعث تخریب یا غیر فعال شدن آنها می گردند. این مواد نسبت به اسپور باکتری حتی در غلظت های بالا بی تاثیر می باشند. اتانول و ایزوپروپانول غشای سلول های باکتری را تخریب می کنند. اتانول از سنتز RNA ، DNA، پروتئین ها وپتیدوگلیکان در اشرشیاکلی جلوگیری به عمل می آورد. به خاطر اینکه الکل های مطلق (بدون آب) و حتی الکل های حاوی آب می توانند باکتری را تخریب کنند معمولا محلول %۷۰ ایزوپروپانول یا اتانول استفاده می گردد. از این مواد در بیمارستان ها، آزمایشگاه های بیولوژیکی، ژل های ضد عفونی کننده و محصولات پاک کننده دست استفاده می گردد. به دلیل فراریت بالای این مواد می توانند محافظت های نسبتاً کوتاه مدت را بدون وجود هیچ گونه اثری از ماده تامین کنند.
پراکسیژن ها مواد ضد میکروب بسیار قوی می باشند. از معروفترین پراکسیژن ها می توان به پراکسید هیدروژن، پر استیک اسید و ازن اشاره کرد. این مواد آنزیم ها و پروتئین ها را از طریق اکسیداسیون گروه های تیول تخریب می کنند. به خاطر دی پلیمریزاسیون کلاژن یا ژلاتین، این مواد در مقابل اسپورها موثر می باشند و همچنین با وجود اکسیژن بیو فیلم را از بین برده و به نفوذ عامل فعال کمک می کنند. پراکسید هیدروژن یک عامل اکسید کننده می باشد. رادیکال هیدروکسیل(OH) گروه های تیول را در میکروارگانیسم مورد نظر اکسید می کند. پر استیک اسید قویترین پر اکسیژن می باشد که از بین برنده باکتری، قارچ و اسپورها می باشد که مکانیسم این ماده اکسیداسیون رادیکال آزاد آنزیم ها و گروه های تیول پروتئین می باشد. پراکسید هیدروژن و پراستیک اسید در هوای گرم تبخیر می شوند و در آب و اکسیژن تخریب شده و بنابراین برای محیط خطرناک می باشند[۲].
واکنشی (۱)[۲] 
ازن از بین برنده بسیار قوی باکتری، قارچ و اسپور می باشد. ازن جهت محافظت آب در مقابل آلودگی های پنهان به اندازه کافی پایدار نمی باشد. همچنین ازن برای انسان نیز بسیار خطرناک است و پلیمرها را تخریب و در هنگام تماس با فلزات باعث زنگ زدگی آنها می گردد[۲].
فنل ها و فنل های کلرینه شده برای ضد عفونی یا نگهداری استفاده می گردند. فنل ها موجب کاهش اجزاء سازنده درون سلولی باکتری می شوند. این ماده در غلظت های پایین غیر فعال می باشد، همچنین فنل ها در مقابل اسپور باکتری حتی در غلظت های بالا نیز غیر فعال می باشند. کلروکروزول و تریکلوسان نمونه هایی از فنل های کلرینه شده می باشند. این مواد بلافاصله به لایه دوتایی فسفولیپیدها نفوذ کرده، استحکام غشاء باکتری را از بین می برند. فنل های کلرینه شده به خارج شدن مواد از درون سلول باکتری و انعقاد سرعت می بخشد. فنل های کلرینه شده عمدتاً برای پاکسازی کف ها، سطل های زباله، دستشویی ها و سطوح دیگر استفاده می گردند. تریکلوسان در هنگام تماس باعث غیر فعال شدن باکتری می گردد ولیکن بازده این ماده بالا نمی باشد. تریکلوسان اساساً از رشد باکتری و قارچ جلوگیری می کند. از تریکلوسان به دلیل غیر مضر بودن به عنوان ماده سازنده صابون های ضد میکروب، اسپری ها، شامپوی بدن و ژل های ضد عفونی کننده دست استفاده می گردد. تریکلوسان نسبت به اشرشیا کلی (گرم منفی) و استافیلوکوکوس (گرم مثبت) مقاوم می باشد[۲].
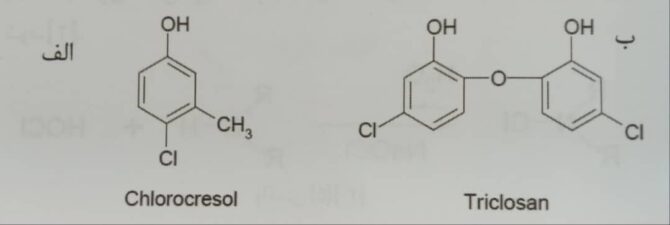
شکل ۴- ساختارهای الف- کلروکروزول، ب- تریکلوسان [۲]
یون های فلزی مانند نقره، جیوه، زینک، آرسنیک، آنتیموان و نمک های آنها یا ترکیبات آلی جیوه و نقره برای حیات موجودات زنده ذره بینی خطرناک می باشند. کمپلکس پون های فلزی با پروتئین ها باعث رسوب پروتئین ها شده و سپس قطع پیوندهای دی سولفیدی درون پروتئین ها را منجر می گردند. بنابراین، از آرایش فضایی آنزیم ها و پروتئین ها برای اتصال به DNA جلوگیری به عمل می آورد. نقره و جیوه در مقال اسپورها موثر نمی باشند، اما در جلوگیری از رشد باکتری از اسپورها موثر می باشند. نمکهای فلزات سنگین ارزان قیمت بوده و از بین برنده باکتری می باشند از آنها نیز می توان به عنوان ماده فعال در فرمولاسیون ضد چرک استفاده کرد. کلرید جیوه از بین برنده اسپورها می باشد اما استفاده از کلرید جیوه ممنوع می باشد که ناشی از مشکلات زیست محیطی این ماده می باشد[۲].
هالوژن ها مانند کلر ، برم، ید، هیپوکلرو اسید ، هیپو برومو اسید، هیپوکلریت سدیم و دی اکسید کلر مواد ضدمیکروبی قوی می باشند. گروه های آمینودر پروتئین ها توسط ترکیبات هالوژن، هالوژنه می شوند. کلر می تواند گروه سولفیدریل در دی هیدروژن تری فسفوریک – آنزیمی که اکسیداسیون تری فسفوریک اسید به اسید فسفوگلیسیریک را انجام می دهد- اکسید نماید. فعالیت آنزیمی از بین می رود. ترکیبات هالوژن، از جمله هیپوکلریت ها اکسید کننده های قوی و ارزان قیمتی می باشند که از بین برنده باکتری، قارچ و اسپور می باشند. ترکیبات هالوژن واکنشگرهای چند منظوره می باشند یعنی هم بر دیواره سلولی و هم بر گروه های آمینو در پروتئین ها تاثیر گذار می باشند. دی اکسید کلر در مقابل باکتری، قارچ، پروتوزوا و جلبک ها فعال می باشد. در سیستم های مایی و استخرهای شنا، کار یک ماده ضدعفونی کننده اصلی به شمار می آید. هیپو کلرو اسید محصول واکنشی کلر و آب میباشد[۲].
واکنش (۲)[۲] 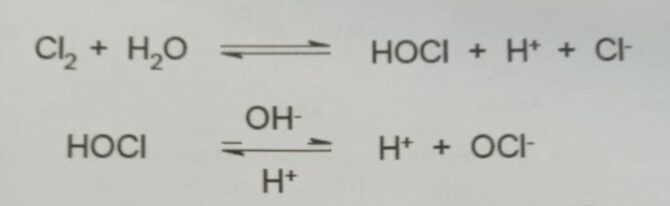
مقدار pKa هیپو کلرو اسید در دمای اتاق ۶/۷ می باشد، بنابراین، قسمت اعظم هیپوکلرو اسید در ۶/۷ > pHبه شکل خنثی و در۶/۷
شکل ۵- ساختار – N هالامین [۲]
در – N هالامین، R و R′ یک گروه آلی (گروه آلکیل و گروه کربونیل)، گروه معدنی (فسفات، سولفات)، هیدروژن یا هالوژن می باشد. هنگامی که R و ‘R هر دو گروه معدنی، هیدروژن یا هالوژن باشند، یک – N هالامین معدنی خواهیم داشت. بعضی ساختارهای – N هالامین معدنی در شکل ۶ نشان داده شده است[۲].
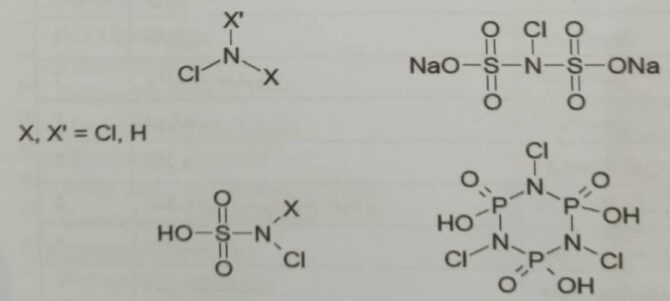
شکل ۶- ساختار ترکیبات – N هالامین معدنی [۲]
اگر گروه R یک گروه آلی باشد، – N هالامین آلی خواهیم داشت و ساختارهای اصلی آمین ها، آمیدها و ایمیدها می باشد. – N هالامین آلی، از خود پایداری هالوژن و اثر ضد باکتری نشان میدهد[۲].
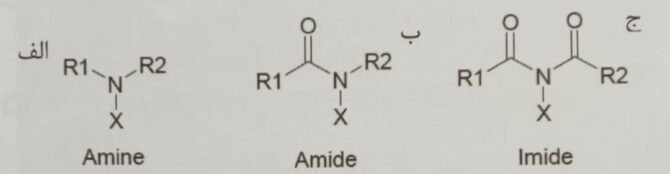
شکل ۷- ساختار ترکیبات الف. – N هالامین آمینی، ب. – N هالامین آمیدی، ج. – N هالامین ایمیدی[۲]
در مورد آمین، یک گروه الکترون دهنده آلکیل مجاور نیتروژن پیوند N-X را پایدار می کند، در این سه حالت هالوژن در آمین باید پایدارتر باشد، که این به معنی آن است که کلر آزادی که از -N هالامین آزاد می شود بسیار تحت تاثیر پیوند بوده بنابراین، N-X در آمین ها فعالیت باکتری کشی را برای مدت زمان طولانی نگه می دارد[۲].
در حالت ایمیدی که در گروه کربونیل الکترون گیرنده کنار پیوند N-X وجود دارد که به خاطر ناپایداری دو گروه کربونیل، پیوند N-X تمایل به آزاد سازی سریع هالوژن دارد، به عبارت دیگر، به جای پیوند N-X، N- برای پایدار سازی ترجیح داده می شود این باعث فعالیت باکتری کشی سریع می گردد.
در مورد آمیدها، در زمان یکسان گروه الکترون دهنده و گروه الکترون گیرنده وجود دارد در نتیجه، پایداری و سرعت آزاد سازی هالوژن بین آمین و ایمید می باشد، بنابراین، آمین پایین ترین ثابت تفکیک را دارا می باشد و بسیار پایدار بوده بر عکس آن ایمید از بالاترین ثابت تفکیک و کمترین میزان پایداری برخوردار می باشد[۲].
فاکتور دیگر برای پایداری پیوند بین هالوژن و نیتروژن نوع هالوژن میباشد. بزرگترین پیوندی که بین هالوژن و نیتروژن را بتواند بپوشاند، پیوند – N هالامین قویتری ایجاد می کند. در میان هالوژن ها به جزء فلوئور ، کلر کوچکترین آن هاست. بنابراین، پیوندهای کلر با نیتروژن با بالاترین همپوشانی همراه خواهد بود. پایداری بر حسب همپوشانی هالوژن[۲]:
واکنش (۳)[۲] N-Cl > N-Br > N-I
نشان داده شده است که در حالت مشابه در – N هالامین، N-Br فعالیت ضدباکتری سریعتری نسبت به N-CI دارا می باشد[۲].
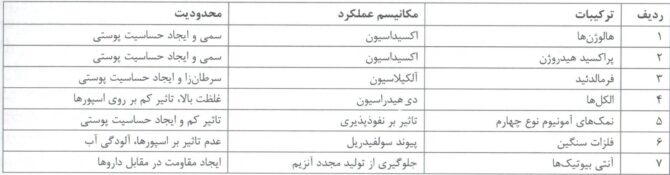
جدول ۱- ترکیبات ضد میکروب و محدودیت های آنها[۳]
اگر یک -α هیدروژن در یک آمین یا آمید وجود داشته باشد، هالوژن در پیوند N-X می تواند دی هیدرو هالوژناسیون را با -α هیدروژن مجاور برقرار کنید تا پیوندهای C=N شکل بگیرد[۲].
واکنش (۴)[۲] 
به طور کلی، اشعه ماوراء بنفش و حرارت این نوع واکنش را تسریع می بخشد. با از دست دادن هالوژن از طریق دی هیدروهالوژناسیون، دیگر یک – N هالامین ضدباکتری نخواهیم داشت. برای جلوگیری از برگشتن دی هیدرو هالوژناسیون، بهتر است نیتروژن در ساختار هتروسیکلیک باشد . بنابراین، یک ضد باکتری – N هالامین آلى حلقوی بدون -α هیدروژن بهترین گزینه می باشد. تا به امروز گروه ورلی در دانشگاه آبورن مواد – N هالامین حلقوی مختلف راسنتز کرده اند که در شکل ۸ نشان داده شده است[۲].
از ویژگی های بارز – N هالامین، به عنوان یک ماده از بین برنده باکتری، می توان به توانایی تجدید اشاره کرد. حتی اگر این ماده بعد از استفاده های مکرر هالوژن خود را از دست بدهد، هالوژن از طریق هالوژناسیون ساده با محلول هیپوکلریت سدیم یا سفید کننده های خانگی ایجاد می شود تا خاصیت ضد باکتری همان طور که در واکنش ۵ نشان داده شده است دوباره احیا شود[۲].
واکنش (۵)[۲] 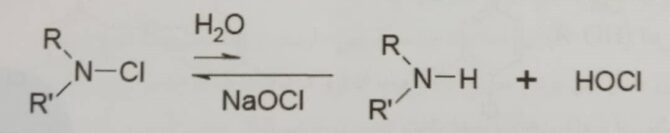
همان طور که اشاره شد، مواد کاتیونیک، الکل ها، فنل ها، فنل های کلرینه شده، یون های فلزی هم باکتری گرم مثبت و هم گرم منفی را از بین می برند در صورتی که – N هالامین ها، آلدئیدها و پراکسیژن ها طیف وسیعی از باکتری ها و اسپور ها را از بین می برند. توانایی تجدید و تاثیر بر طیف وسیعی از میکروارگانیسم ها و از بین برنده اسپورها باعث تولید – N هالامین حلقه ای مختلفی شده است. تا کنون از – N هالامین ها جهت تصفیه آب استفاده می شده است[۲].
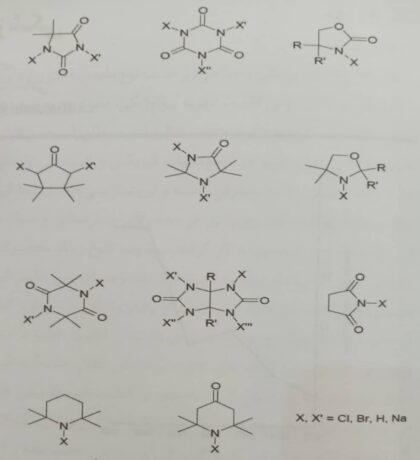
شکل ۸- ساختارهای – N هالامین حلقوی آلى[۲]
منابع
۱- Gupta, Deepti; Antimicrobial Treatments for Textiles: Review Article: Indian Journal of Fiber Textile Research, Vol. 32. June
۲۰۰۷. pp. 254-263.
۲- Lee, Jaewoong: Synthesis and Applications of Novel Antimicrobial Polymeric Materials: Dissertation of Doctor of Philosophy: Auburn University: 2006.
۳- XU, Xiangjing: Antibacterial finishing of Cellulosic Clothing Material; Dissertation of Doctor of Philosophy: University of California: 2002.

